
用于研究HUVEC的iPSC多能性和毛細血管網絡形成的
高級體外3D模型
Josefin Blell,理學碩士,Shubhankar Nath,博士,
Christen Boyer,博士和 Itedale Namro Redwan,博士
CELLINK,瑞典哥德堡
將人臍靜脈內皮細胞(HUVECs)和人真皮成纖維細胞(HDFs)共培養和誘導多能干細胞(iPSCs)單培養 ??分別包埋于選定的生物材料中7d。利用免疫熒光成像將這些三維培養系統的細胞標記與二維培養進行了比較,并證明了使用細胞相關材料的重要性。HUVEC與HDF共培養的時間是獲得復雜結構的重要因素。在3D ?????中延長培養時間導致觀察到促血管生成結構,這一現象只在3D中觀察到。與2D相比,iPSCs在3D培養時形成團簇,細胞組裝重塑,形成環形結構,并表達多能性標記OCT4和NANOG。iPSCs可以在3D培養中保持其 ??多能性,這使得科學家可以設計更先進的實驗,在這種實驗中,干細胞可以在3D嵌入后進行分化。
由于整個 3D 矩陣中細胞自組裝和重組的差異,3D 生物打印和共培養類器官最近受到了廣泛關注。 單一培養類器官傾向于在 3D 中聚集以最大化粘附并最小化能量,而共培養則根據細胞間粘附的差異進行重組
(Foty,2005 年;Napolitano,2007 年)。 一般來說,不同的細胞類型在細胞重組過程中也會相互顯著影響。 例如,單獨的內皮祖細胞不會形成血管組織,但當與人真皮成纖維細胞(HDF) 或平滑肌細胞類型共培養時,血管內皮管可以在多孔生物材料或生物墨水中形成 (Unger, 2007)。 一項使用人臍靜脈內皮細胞(HUVEC) 的研究表明,這些細胞在沒有成纖維細胞的情況下無法形成內皮細胞腔,這凸顯了共培養系統的重要性(Newman,2011)。
在研究過程中,對HUVEC培養的相關標記進行了分析。分化簇31(CD31)是一種內皮細胞特異性標記物,用于二維和三維培養中監測內皮細胞的分化、自組裝和血管生成。CD31在HUVECs表面表達,并已知在類有機分子內自組織(Wu,2004)。occludens-1(ZO-1)是一種細胞質蛋白,作為支架分子,是上皮細胞和內皮細胞 ??緊密連接的組成部分。ZO-1氨基末端能與claudins和α-catenin/cadherins結合,羧基末端能與肌動蛋白細胞骨架相互作用(Itoh,1997)。表明在上皮細胞中,ZO-1是三維形成管腔所必需的。在排列的HUVEC三維培養中,ZO-1在緊密連接的功能性內皮形成中發揮重要作用(Kang,2018)。
多能性標記OCT4、SOX2和NANOG在維持胚胎干細胞和誘導多能性干細胞(iPSCs)的穩定中起著關鍵作用。證據表明,在分化和發育過程中,它們表達模式的改變控制著細胞的命運(Wang,2012)。例如,OCT4 調節BMP4通路并與之相互作用,以指定不同的發育命運。高水平的OCT4能在缺乏BMP4的情況下自我更新,但在存在BMP4的情況下指定中胚層。低水平的OCT4在沒有BMP4的情況下誘導胚胎外胚層分化,但在 ??有BMP4的情況下明確胚胎外譜系。SOX2抑制中胚層分化, 而NANOG抑制胚胎外胚層分化(Rizzino, 2016)。這表明了在3D基質中嵌入iPSCs或在2D中培養時保持這些多能性標記的重要性。
將HUVECs培養在大血管內皮細胞培養基中,添加生長補品(Cellworks,ZHM-2953),并添加0.1%慶大霉素/ 兩性霉素抗生素(Gibco,R-015-10)。新生兒HDF在成纖維細胞生長培養基(促進細胞,C-23010)中培養。iPSCs按Celllatis’s培養方案培養。iPSCs在Synthemax II-SC基質(Corning,3535)涂層上培養,并用Versene溶液(Gibco,15040-033)分離。培養基為Cellartis DEF-CS 500無Xeno培養基(Takara Bio,Y30045),添加添加劑(Takara Bio,Y30042)和1%慶大霉素/兩性霉素(Gibco,R-015-10)。
對于HUVEC-HDF生物打印,將GFP標記的HUVEC細胞以1:1的比例與HDFs混合,并與bioink、Matrigel Matrix(Corning,354234)或GelMA(CELLINK,IK305102)混合,以200萬細胞/ml的比例添加纖維連接蛋白, bioink與細胞的比例為9:1。bioink和細胞在兩個注射器之間混合,然后通過連接的22g噴嘴(CELLINK, NZ4220005001)分配。Gelma基樣品在3 cm處光交聯15秒,Matrigel基樣品在37℃下熱交聯20分鐘后加入介質。在每周更換3次的HUVECs培養基中培養。
對于iPSCs生物打印,細胞以100萬個細胞/ml的比例在兩個注射器之間以10:1的比例bioink(Matrigel或
GelMA?, 補 充 層 粘 連 蛋 白 521(GelMA+LN521)) 與 細 胞 (?V/V?)?混 合 , 并 通 過 20g?噴 嘴
(CELLINK,NZ4200005001)分配。GelMA光交聯5~10秒,Matrigel熱交聯。培養基每天更換。
一般情況下,所有樣品在未經處理的96孔板(VWR,7342781)中以液滴形式生物打印,使用
BIO X(CELLINK,D16110020717)和在100微升相應生長培養基存在下培養所有的光交聯都是在405nm的光模塊上進行的。2D細胞在腔室細胞上培養
培養幻燈片(Falcon,354108)。所有培養物均保持在37°C和5%CO2下。分別于3d和2d培養5~14d和3~4d, 用免疫組織化學(IHC)分析不同標記物的表達。
用4%多聚甲醛(CaCl2 50 mM)固定5~6小時,然后用乙醇和二甲苯脫水。在用切片機切片至5μm厚之前,用石蠟浸潤和包埋這些結構。切片在顯微鏡載玻片上固定,并在二甲苯和乙醇中分離。用抗原回收緩 ??沖液煮沸制備抗體染色樣品,然后用封閉液處理。2D細胞固定1~3h,用0.5%Triton-X100滲透,用封閉液 ??處理。將一抗溶液加入所有玻片中,在4℃下孵育過夜。切片經PBS洗滌后,在室溫下用二次抗體處理1h。細胞核用NucBlue固定細胞ReadyProbes試劑(Invitrogen,R37606)反染。將蓋片安裝在載玻片上,并附上氟蒙特-G(Invitrogen,00-4958-02)。用熒光共聚焦顯微鏡(ZEISS LSM710 NLO)在相同的采集參數下分析次級抗體的定位。
HUVEC-HDF共培養:為了確定不同基質對HUVECs和HDF共培養的影響,首先用熒光顯微鏡觀察其形態差異。生長在Matrigel和GelMA纖維連接蛋白中的細胞形成致密的網絡,表現為細長的表型,而2D細胞表現為 ??細長較少而圓形較多的形態(圖1)。此外,二維圖像顯示GFP-HUVECs在少數上皮細胞中呈簇狀分布。
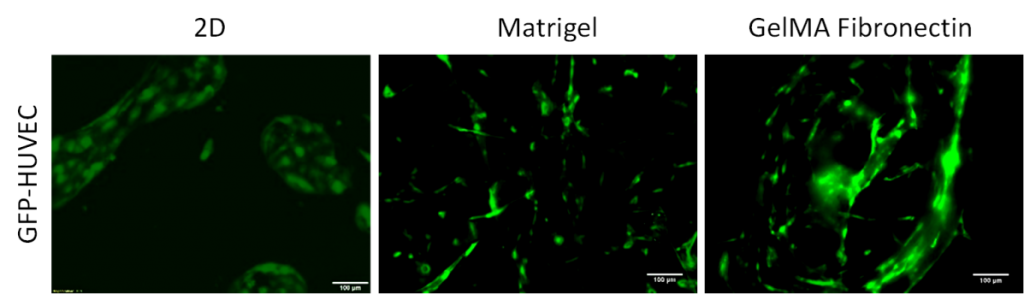
圖1.GFP 標記的 HUVEC(綠色)在 2D 單層(第 3 天)和Matrigel(第 7 天)和 GelMA 纖連蛋白(第 14 天)上的 3D 培養中與 HDF 共培養。 比例尺= 100 μm。
ZO-1染色:除了細胞形態外,緊密連接在內皮屏障功能的調節中起著至關重要的作用。為此,對緊密連接相關蛋白ZO-1進行免疫染色,分析其在2D和不同3D基質中的細胞分布。如圖2所示, 在第15 天,在GelMA纖維連接蛋白Sam-ples 中檢測到高水平的ZO-1。在GelMA 纖維-果膠樣品中也觀察到幾個芽, 表明這些細胞具有形成毛細血管樣結構的能力。有趣的是,ZO-1二維染色不僅局限于HUVECs , 也可在HDFs中檢測到, 提示一個含有合適ECM成分的三維環境對維持不同細胞系蛋白質的結構和時空表達是必要的。
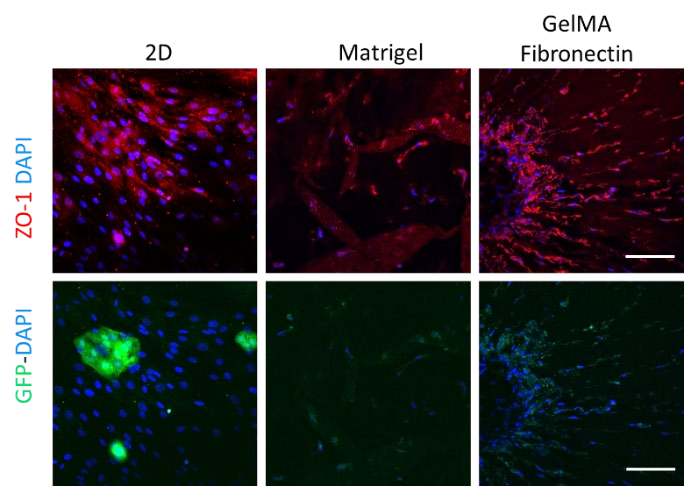
圖2.GFP-HUVEC和HDF共培養2d(第3天)和Matrigel
(第8天)和GelMA纖維連接蛋白(第15天)分別用ZO- 1(紅色)和DAPI(藍色)染色。比例尺=100μm。
CD31染色:為進一步鑒定共培養物,對特異性內皮標記物CD31進行免疫熒光染色。毫不奇怪,CD31的表達僅限于2D 和 GelMA 纖 維 連 接 蛋 白 第 15 天 的HUVECs,這可以通過重疊表達GFP和CD31/DAPI 的HUVECs 圖像面板顯示(圖3)。不幸的是,在atrigel第8天培養中檢測到非常低水平的CD31,這可以由GFP信號所示的視野中HUVECs細胞的非常低數量或缺乏來解釋(圖3)。
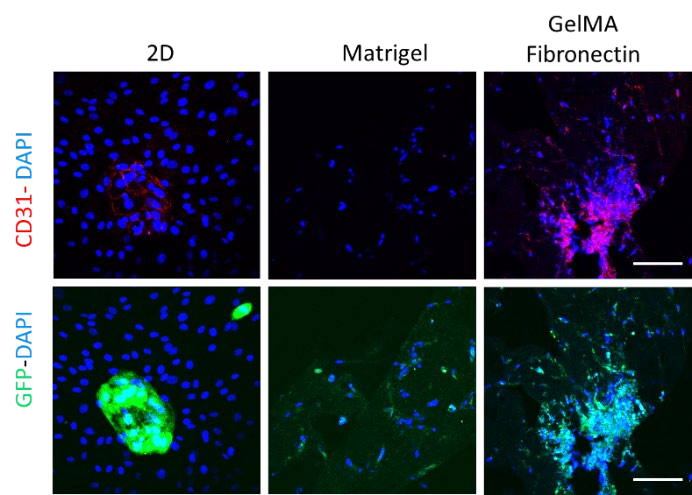
圖3.GFP-HUVEC與HDF共培養2d(3d)、3d、3d,CD31(紅)、DAPI(藍)染色,Matrigel(8d)、GelMA纖維連 接蛋白(15d)染色。比例尺=100μm。
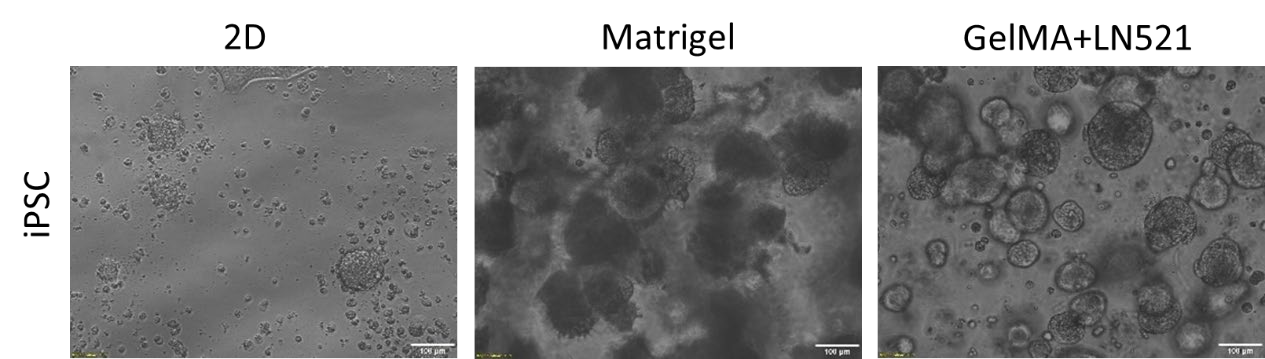
圖4.在3DMatrigel或Gelma+LN521中對培養4d后的iPSCs進行2d和7d的亮場圖像。比例尺=100μm。
接下來,用亮場顯微鏡觀察生長在2D和3D簇中的iPSC細胞的形態,如圖4所示。在Matrigel和Gelma+LN521 中均觀察到不同大小的球體。此外,還對三個多能性標記OCT4、NANOG和SOX2的表達進行了評估。
多能性標記物 OCT4 在所有條件下都有不同程度的表達,如圖 5(上圖)所示。在 2D 中,在細胞簇的周邊觀察到最高的信號強度。而在 Matrigel 中,信號強度均勻分布在整個樣品上。對于圖 5(?中圖)中的NANOG 染色樣品,觀察到非常相似的表達模式。需要更長的曝光時間來可視化圖 5(下圖)所示的 2D 樣品中的 SOX2 表達。除了多能標記物的表達外,還觀察到 GelMA+LN521 中細胞簇的環狀形態,主要是在Matrigel 中。這些空心簇類似于神經玫瑰花結或早期中胚層結構(Muratore,2014)。然而,需要進一步分析以確認任何潛在的分化,因為iPSC 在觀察到細胞聚集的所有條件下都保留了 OCT4 和 NANOG 的表達。這些多能性標記物不是所有分化命運的泛阻遏物,而是每個控制向特定譜系的分化。例如,NANOG 抑制胚胎外胚層分化而對其他譜系幾乎沒有影響,而SOX2 抑制中內胚層分化(Wang,2012)。轉錄因子小心翼翼地相互作用以將細胞保持在多能狀態,與其他因子相比, 一種因子表達的微小變化可導致分化
(Rizzino,2016 年)。免疫熒光觀察到的微小變化不是定量的,但表明即使在嵌入和 3D 生物打印后仍保留了多能性標記,為 3D 生物打印過程后的分化開辟了新的機會。
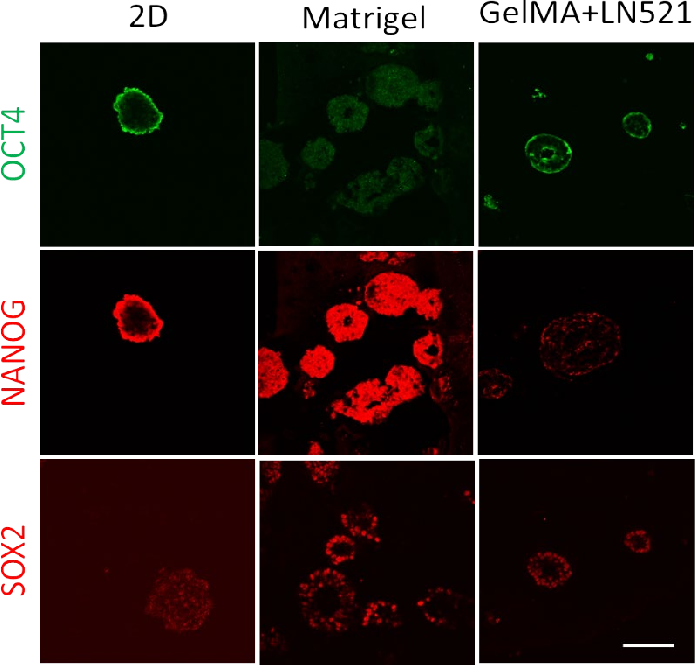
圖 5. 2D 培養 4 天和 3D Matrigel 或GelMA+LN521 培養 7 天后 iPSC 中的OCT4、NANOG 和 SOX2 表達。 所有圖像均使用相同的采集參數捕獲,但SOX2 的 2D 圖像已為可視化進行了增強。 比例尺 = 100 μm。
與二維細胞培養相比,3D生物打印顯示出多種優勢,包括多細胞結構的精確幾何排列,可以更好地再現自然的三維人體生理學。細胞根據來自周圍細胞和環境的外部信號進行自組裝。這一重要現象有助于理解胚 ??胎發生、血管生成、傷口愈合和腫瘤形成,也可能有助于開發新的生物人工器官血管化藥物和途徑。這項 ??研究得出以下結論:
參考文獻
the formation of microcapillary-like structures on three-dimensional porous biomaterials. Biomaterials. 2007; 28(27): 3965–3976. DOI:10.1016/j.biomaterials.2007.05.032.

